Сравнительное изучение иммуномодулирующих свойств хитозана и его производных

Иванушко Л.А.1 , Соловьева Т.Ф.2 , Запорожец Т.С.1 , Лукьянов П.А.2 , Горбач В.И.2 , Беседнова Н.Н.1 1 ГУ Научно-исследовательский институт эпидемиологии и микробиологии СО РАМН 2 Тихоокеанский институт биоорганической химии ДВО РАН, г. Владивосток
Проведено сравнительное изучение иммуномодулирующих свойств высокомолекулярного хитозана (Х-ВМ) и его производных: низкомолекулярного хитозана (Х-НМ), N-3-гидроксимиристоил-Х-НМ, N-3-гидроксимиристоилхитоолигосахаридов (N-ацилхитобиозы, -хитотриозы, -хитотетраозы), карбоксиметилхитозана, карбоксиэтилхитозана, карбоксипропилхитозана. Установлено, что химическая модификация хитозана влияет на его биологическую активность. Синтезированные производные хитозана имеют улучшенные физико-химические свойства (хорошая растворимость в нейтральных и щелочных растворах, низкая вязкость в кислых растворах, хорошая всасываемость из желудочно-кишечного тракта) по сравнению с исходным высокомолекулярным хитозаном, обладают иммуномодулирующими свойствами и являются перспективными веществами для создания лекарственных препаратов и биологически активных добавок к пище (БАДов).
Введение В настоящее время продолжает оставаться актуальным поиск новых высокоэффективных малотоксичных биологически активных препаратов из доступных природных источников. Перспективными в этом смысле веществами являются полисахариды и углеводосодержащие биополимеры растительного и животного происхождения, которые благодаря способности к многоточечному взаимодействию с поверхностью клеток могут обеспечивать выраженную стимуляцию различных этапов иммуногенеза.
В связи с этим поликатионные и полианионные полисахариды, широко представленные в морских водорослях и ракообразных, могут рассматриваться как потенциальные иммуномодуляторы. Среди полимеров природного происхождения хитин и хитозан, благодаря своим уникальным свойствам, привлекают внимание большого числа специалистов самых разных специальностей.
Хитозан – поликатионный линейный полисахарид, полимерная цепь которого состоит из β-1,4-связанных остатков D-глюкозамина и N-ацетил-D-глюкозамина, широко используется в медицинских целях и в ветеринарии, поэтому его фармакологические свойства и, в частности, влияние на клетки иммунной системы, изучены достаточно подробно. Возросший интерес к хитину и хитозану объясняется их выраженной биологической активностью (противомикробной, противоопухолевой, противовоспалительной, иммуномодулирующей и др.).
Наиболее перспективными являются хитозаны, низкой молекулярной массы и хитоолигосахариды, получаемые химической или ферментативной деградацией исходного продукта. Другим методом изменения свойств хитозана является регуляция количества свободных аминогрупп в молекуле путем избирательного ацилирования части из них [8]. Введение ацильных групп увеличивает гидрофобность молекулы хитозана и может влиять на его взаимодействие с мембранами клеток-мишеней. Среди анионных (или цвитерионных) производных хитозана наиболее изучены сульфатированные хитозаны, которые интересны, прежде всего, из-за их антивирусной и антикоагулянтной активности, и в меньшей степени – карбоксиалкилхитозаны. Иммуномодулирующая активность карбоксиэтил- и карбоксипропилхитозанов, которые наряду с карбоксиметилхитозаном были синтезированы и изучены в данной работе, ранее не исследовалась.
Целью настоящей работы явилось сравнительное изучение иммуномодулирующей активности хитозана и его производных.
Материалы и методы
В работе использовали хитозан и его производные: исходный высокомолекулярный хитозан (Х-ВМ), низкомолекулярный хитозан (Х-НМ), N-ацилхитобиоза (I), N-ацилхитотриоза (II), N-ацилхитотетраоза (III), N-ацилированный низкомолекулярный хитозан (IV) карбоксиметилхитозан (КМ), карбоксиэтилхитозан (КЭ), карбоксипропилхитозан (КП). Для получения хитозана (Х-ВМ) нами был использован мягкий метод N-дезацетилирования коммерческого хитина с применением в качестве реагента смеси водной щелочи (40% NaOH) с изопропиловым спиртом (1/16 v/v). Реакционную смесь кипятили 7 часов, осадок отфильтровали, растворили в воде (рН 5,0), подкисленной соляной кислотой, и лиофильно высушили. В результате с выходом 75,5% был получен хитозан с молекулярной массой 130 kDa и степенью N-ацетилирования 1,7%. Хитоолигосахариды (биоза, триоза, тетраоза) были получены кислотным гидролизом хитозана с концентрированной соляной кислотой с последующим разделением на ионообменной смоле Amberlite CG-120 (MCW, США). Хитозан низкой молекулярной массы (4-5 kDa) (Х-НМ) получали деполимеризацией высокомолекулярного хитозана с 2,5% перекисью водорода (48 ч, 37°С). Хитоолигосахариды и хитозан низкой молекулярной массы были ацилированы N-гидроксисукцинимидным эфиром 3-гидрокситетрадекановой кислоты в смеси растворителей вода – N,N-диметилформамид. В результате были получены их производные, содержащие в составе один остаток жирной кислоты на молекулу олиго- и полисахарида. N- и 6-О-карбоксиалкил (метил, этил, пропил)-хитозаны были синтезированы алкилированием хитозана в щелочной среде омега-галогенпроизводными уксусной, пропионовой и бутановой кислот. Степень замещения амино- и гидроксигрупп в молекуле хитозана составила 65±5% для всех карбоксиалкил-производных.
Эти цвиттерионные производные отличаются от исходного хитозана зарядом и хорошей растворимостью в воде при нейтральных и основных рН. Эксперименты выполнены на неинбредных мышах и мышах линии CBA(C57xBlac)F1 массой 16-18 г, находящихся на стандартной диете в боксированных помещениях, с соблюдением всех правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах. Гуморальный иммунный ответ оценивали по числу антителообразующих клеток (АОК) в селезенке мышей на 4 сутки после иммунизации мышей эритроцитами барана (ЭБ) и титрам гемагглютининов и гемолизинов в сыворотке крови иммунизированных животных. В качестве показателя клеточного иммунного ответа использовали реакцию гиперчувствительности замедленного типа (ГЗТ). Для оценки влияния производных хитозана на функциональную активность фагоцитирующих клеток использовали нейтрофилы (Нф), полученные из перитонеальной полости мышей через 4 часа после внутрибрюшинной инъекции 1 мл стерильного 1% раствора пептона. В модельной системе in vitro исследуемые вещества добавляли к клеточной взвеси и инкубировали 30 мин при 37°С в концентрации 100 мкг/мл. Адгезивные свойства Нф оценивали спектрофотометрическим методом, способность к продукции активных форм кислорода (АФК) определяли с помощью теста восстановления нитросинего тетразолия (НСТ). Результаты выражали в виде индекса стимуляции: ИС = ОПо/ОПк х 100%, где ИС – индекс стимуляции, ОПо – оптическая плотность показателей опытной группы, ОПк – оптическая плотность показателей контрольной группы. Фагоцитарную активность Нф оценивали, используя фагоцитарный показатель (ФП – процент клеток, участвующих в процессе поглощения) и фагоцитарное число (ФЧ – число объектов фагоцитоза (частицы латекса), поглощенных одним нейтрофилом). Концентрацию цитокинов в супернатантах клеток цельной крови измеряли методом твердофазного иммуноферментного анализа с использованием коммерческих тест-систем «Протеиновый контур» (IL-8, IFNγ, IL-4, IL-2) и «Цитокин» (TNFα, IL-1α).
При исследовании спонтанного синтеза цитокинов исследуемые образцы добавляли в кровь интактных доноров в конечной концентрации 100 мкг/мл. Синтез IL-1α и IL-8 индуцировали липополисахаридом (ЛПС) E. coli («Sigma») 10 мкг/мл в течение 24 часов, TNFα – в течение 48 часов. Синтез IL-4, IL-10 индуцировали конканавалином (KонА) («Serva») 10 мкг/мл в течение 24 часов, IFNγ – 10 мкг/мл 72 часа. Костимулирующее влияние исследуемых биополимеров изучали при их совместном действии с КонА и ЛПС. Клетки инкубировали при 37°С в атмосфере 5% СО2, после чего отбирали супернатанты и определяли концентрацию цитокинов. Статистическую обработку полученных данных проводили с помощью пакета программ «Statistica-5» и «Excel». Использовались следующие методы статистического анализа: проверка нормальности распределения количественных признаков при малом числе наблюдений, проверка равенства генеральных дисперсий, t-критерий Стьюдента (при нормальном распределении количественных признаков), непараметрический критерий W Вилкоксона (при ненормальном распределении количественных признаков). Выборочные параметры, приводимые далее в таблицах, имеют следующие обозначения: средняя арифметическая (М), средняя ошибка средней арифметической (m), объем анализируемой подгруппы (n), p – достигнутый уровень значимости. Уровень доверительной вероятности был задан равным 95%.
Результаты
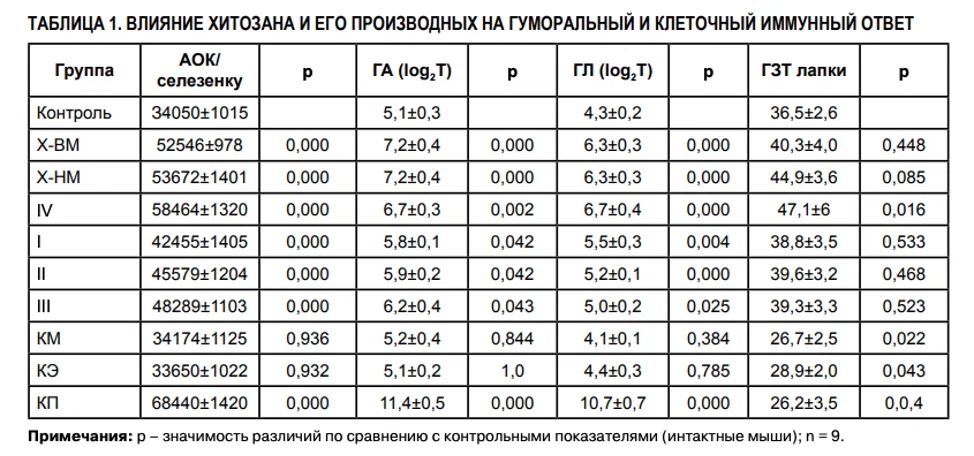
При исследовании влияния хитозана и его производных на гуморальный иммунный ответ было установлено, что Х-ВМ значимо увеличивал количество АОК в селезенках и повышал титры гемагглютининов и гемолизинов в сыворотке крови иммунизированных ЭБ мышей по сравнению с таковыми у животных контрольной группы (интактных) (табл. 1). Деполимеризованный хитозан (Х-НМ), имеющий значительно лучшую растворимость в водных растворах в сравнении с исходным хитозаном, сохранял способность к стимуляции гуморального иммунитета, сравнимую с таковой у Х-ВМ (p = 1,0). Ацилирование низкомолекулярного хитозана (производное IV) не влияло на его способность стимулировать гуморальный иммунитет (p = 1). Способность к стимуляции гуморального иммунитета у N-ацилированных хитоолигосахаридов (биозы – I, триозы – II, тетраозы – III), превышающая таковую у интактных мышей, снижалась по сравнению с Х-НМ и Х-ВМ. Среди анионных производных выраженная способность к продукции АОК и синтезу антител, превышающая таковую у всех исследованных образцов хитозана, выявлена у карбоксипропилхитозана. КМ- и КЭхитозаны адъювантную активность не проявляли (табл. 1). При изучении влияния хитозана и его производных на клеточный иммунитет (табл. 1) были установлены следующие закономерности:
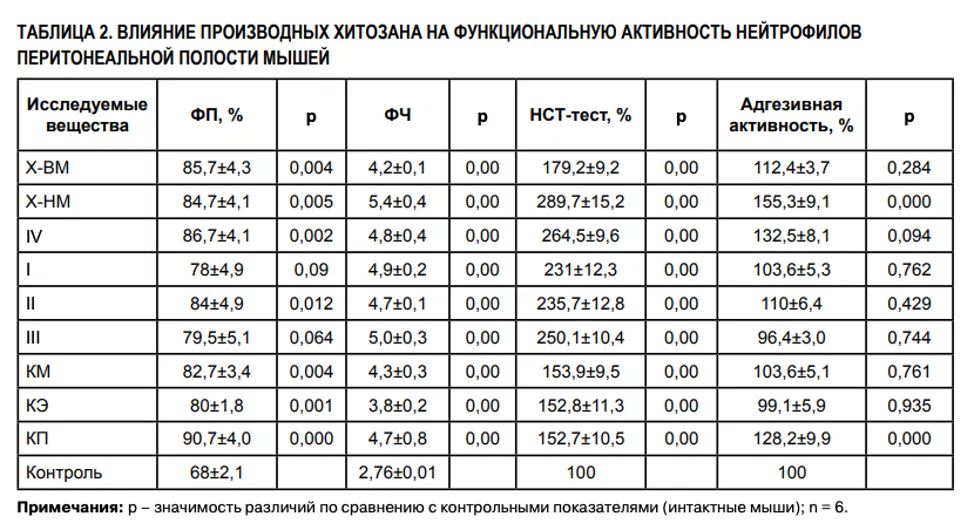
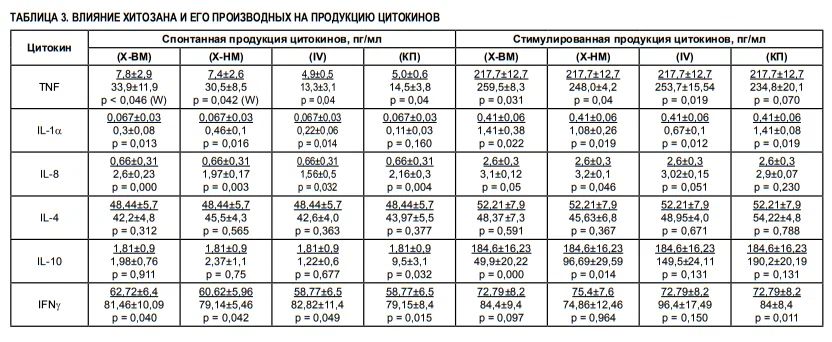
Х-ВМ значимо не изменял интенсивность реакции ГЗТ по сравнению с таковой у животных контрольной группы (интактных). Деполимеризация хитозана (Х-НМ) не вызывала изменений в его способности к стимуляции клеточного иммунитета (p = 0,415). Ацилирование низкомолекулярного хитозана (производное IV) приводило к появлению стимулирующей активности в отношении клеточного иммунитета (p = 0,016). Ацилированные хитоолигосахариды (I, II, III) не изменяли интенсивность реакции ГЗТ по сравнению с таковой у животных контрольной группы (интактных). Карбоксиалкилхитозаны снижали интенсивность реакции ГЗТ (p = 0,022; p = 0,043 и p = 0,04 соответственно). Исходный хитозан (Х-ВМ) значимо увеличивал функциональную активность нейтрофилов (фагоцитоз и бактерицидные свойства) по сравнению с таковой у животных контрольной группы (интактных) (табл. 2). Х-НМ сохранял способность к стимуляции фагоцитарной активности Нф, сравнимую с таковой у Х-ВМ. Способность Х-НМ стимулировать адгезию Нф на пластик и продукцию АФК усиливалась по сравнению с высокомолекулярным хитозаном (p = 0,000 и p = 0,000 соответственно). Ацилирование низкомолекулярного хитозана (производное IV) не изменяло его способности к стимуляции функциональной активности нейтрофилов (ФП: p = 0,868; ФЧ: p = 0,705; НСТ-тест: p = 0,178; адгезивная активность: p = 0,078). Способность к стимуляции фагоцитарной активности нейтрофилов у ацилированных хитоолигосахаридов (производные I, II, III) сохранялась по сравнению с таковой у ацилированного низкомолекулярного хитозана (ФП: p = 0,190; p = 0,678; p = 0,286; ФЧ: p = 0,826; p = 0,807; p = 0,701; НСТ-тест: p = 0,05; p = 0,09; p = 0,322), адгезивная активность производных снижалась до уровня интактного контроля (p = 0,008; p = 0,4; p = 0,000). Введение карбоксиалкильных заместителей в хитозан не вызывало значимого изменения способности биополимера к стимуляции функциональной активности нейтрофилов (ФП: p = 0,62; p = 0,23; p = 0,406; ФЧ: p = 0,75; p = 0,09; p = 0,54; НСТ-тест: p = 0,07; p = 0,08; p = 0,07; адгезивная активность: p = 0,18; p = 0,07; p = 0,152 соответственно для КМ, КЭ, КП). При изучении цитокининдуцирующих свойств хитозана и его производных была установлена способность Х-ВМ усиливать спонтанную и стимулированнную митогенами продукцию TNFα, IL-1α и IL-8 клетками крови доноров (табл. 3). Деполимеризованный хитозан низкой молекулярной массы (Х-НМ) сохранял способность к стимуляции провоспалительных цитокинов, сравнимую с таковой у исходного хитозана. Ацилирование низкомолекулярного хитозана не обеспечивало значимого изменения способности к стимуляции продукции TNFα, IL-1α и IL-8 клетками периферической крови (спонтанная продукция: p = 0,08; 0,06; 0,45 соответственно; стимулированная продукция: p = 0,72; 0,167; 0,333 соответственно). При внесении в культуру клеток крови карбоксипропилхитозана его способность к усилению продукции провоспалительных цитокинов была сопоставима с таковой у Х-ВМ (спонтанная продукция: p = 0,14; 0,313; 0,267 соответственно; стимулированная митогенами продукция: p = 0,278; 1,0; 0,276 соответственно). В то же время все исследуемые образцы хитозана, за исключением карбоксипропилхитозана (КП), не изменяли способность клеток периферической крови кспонтанной продукции противовоспалительных (IL-4, IL-10) цитокинов (табл. 3). Карбоксипропилхитозан значительно стимулировал спонтанную продукцию IL-10 (p = 0,032). Высокомолекулярный (исходный) хитозан (Х-ВМ) и деполимеризованный хитозан низкой молекулярной массы (Х-НМ) снижали стимулированную митогенами продукцию противовоспалительных цитокинов клетками периферической крови. Все исследуемые образцы хитозанов стимулировали продукцию IFNγ – основного маркера субпопуляции Th1, ответственного за развитие клеточного иммунитета, а также резко усиливающего эффекторные функции макрофагов и естественных киллеров, их антимикробную и цитотоксическую активность.
Обсуждение
Проведенные в настоящей работе исследования показали, что синтезированные производные хитозана: низкомолекулярный хитозан, ациливанный низкомолекулярный хитозан, хитоолигосахариды, карбоксипропилхитозан, которые отличаются от исходного хитозана по молекулярному весу, степени гидрофобности и заряду, сохраняют такие его свойства, как адъювантная активность, способность стимулировать функциональную активность нейтрофилов и синтез провоспалительных цитокинов. Карбоксиметил- и карбоксиэтилхитозаны адъювантную активность не проявляли. В то же время между изучаемыми соединениями были обнаружены заметные различия в их иммуномодулирующей активности. Так, ацилированные хитозаны слабо повышали способность нейтрофилов прилипать к пластику, в тот время как карбоксиалкилпроизводные заметно увеличивали их адгезивные свойства. Cинтез активных форм кислорода в НФ более активно стимулировали Х-НМ и его N-ацилированные производные по сравнению с Х-ВМ и карбоксиалкилхитозанами. Исходный хитозан и остальные его низкомолекулярные производные не оказывали влияния на клеточный иммунитет, в то же время ацилированный низкомолекулярный хитозан вызывал его стимуляцию, а все карбоксиалкилпроизводные хитозана значимо снижали интенсивость реакции ГЗТ. Проведенные в настоящей работе исследования показали, что синтезированные производные хитозана: низкомолекулярный хитозан, ацилированный низкомолекулярный хитозан, хитобиоза, хитотриоза, хитотетраоза, а также карбоксипропилхитозан, сохраняют адъювантную активность, способность стимулировать функциональную активность нейтрофилов (фагоцитоз, продукцию АФК) и синтез провоспалительных цитокинов, которые проявляет исходный высокомолекулярный хитозан.
Карбоксиметил- и карбоксиэтилхитозаны адъювантную активность не проявляли. Однако не отмечено четкой зависимости между структурой молекул изучаемых соединений и их способностью влиять на бактерицидную и адгезивную активность нейтрофилов: ацилированные хитозаны слабо повышают способность прилипать к пластику, в то время как карбоксиалкилпроизводные заметно увеличивают адгезивные свойства нейтрофилов. Cинтез активных форм кислорода в НФ более активно стимулировали Х-НМ и его N-ацилированные производные по сравнению с Х-ВМ и карбоксиалкилхитозанами. Все карбоксиалкилпроизводные хитозана значимо снижали интенсивность реакции ГЗТ. Ацилированный низкомолекулярный хитозан вызывал стимуляцию клеточного иммунитета. Исходный хитозан и остальные его низкомолекулярные производные не оказывали влияния на клеточный иммунитет. Хитозан и все его производные увеличивали спонтанную продукцию провоспалительных цитокинов TNFα, IL-1α и IL-8 клетками периферической крови. В активированных клетках с высоким уровнем цитокинов после стимуляции хитозанами продукция TNFα и IL-8 не изменялась или слабо возрастала, а IL-1α заметно увеличивалась. Значимых различий между исследованными производными хитозанами по способности стимулировать синтез провоспалительных цитокинов обнаружено не было. Повышенная продукция провоспалительных цитокинов может быть механизмом, который определяет влияние хитозана и его производных на развитие воспалительной реакции на ранних этапах инфекционного процесса, вызывает эффекты, показанные нами (стимуляцию способности Нф к адгезии на пластик, усиление фагоцитоза и продукции супероксидных радикалов фагоцитами), а также может способствовать стимуляции экспрессии молекул агдезии, выходу Нф в воспалительный очаг, активации Мф и NK, усилению синтеза IFNγ NK-клетками. Все исследуемые образцы производных хитозана не изменяли способность клеток периферической крови к спонтанной и стимулированной продукции противовоспалительного цитокина IL-4. Синтез другого противовоспалительного цитокина, IL-10, по разному регулировался различными производными хитозана. Х-ВМ и деполимеризованный Х-НМ снижали стимулированнную митогенами и не влияли на спонтанную продукцию IL-10 клетками пе-риферической крови. Ацилированный низкомолекулярный хитозан не влиял на спонтанную и стимулированную продукцию этого цитокина. В то же время карбоксипропильное производное хитозана, в отличие от нативного полимера, стимулировал продукцию IL-10 клетками крови. Как известно, IL-10 усиливает пролиферацию В-клеток и Ig-секрецию и является супрессорным фактором для Th1-зависимого иммунного ответа [6]. В этой связи способность карбоксипропилхитозана резко увеличивать спонтанную продукцию IL-10 может быть обусловлена его способностью стимулировать гуморальный и угнетать клеточный иммунный ответ в экспериментальной системе in vivо.
Эти свойства карбоксипропилхитозана создают предпосылки для изучения этого соединения в качестве противовоспалительного средства. Хитозан и его производные повышали спонтанную, но не стимулированную продукцию IFNγ – основного маркера субпопуляции Th1, ответственного за развитие клеточного иммунитета, а также резко усиливающего эффекторные функции макрофагов и естественных киллеров, их антимикробную и цитотоксическую активность. Таким образом, производные хитозана проявляют свойства мультицитокиновых индукторов, оказывая влияние на продукцию цитокинов, вырабатываемых преимущественно Th1 (IFNγ), Th2 (IL-10) и мононуклеарными фагоцитами (TNFα, IL-1α) в культуре клеток цельной крови. Модулирующее действие исследованных производных на продукцию цитокинов зависит от исходного уровня тестируемого цитокина, а в случае IL-10 – и от структуры хитозана. В отличие от Х-ВМ, который плохо растворим в нейтральных и щелочных средах, а в кислых образует вязкие растворы, низкомолекулярные и анионные его производные имеют низкую вязкость и хорошую растворимость в водных средах при физиологических значениях рН. Гидрофобное производное хитозана (Х-НМ) также хорошо растворимо в водных средах, в отличие от описанных в литературе ацилированных хитозанов, так как имеет небольшую молекулярную массу и низкую степень замещения аминогрупп остатками жирной кислоты. Таким образом, исследованные образцы производных хитозана, которые имеют улучшенные физико-химические свойства по сравнению с исходным высокомолекулярным хитозаном, обладают иммуномодулирующими свойствами и являются перспективными веществами для создания лекарственных препаратов и биологически активных добавок к пище. Работа выполнена в рамках интеграционных проектов СО РАМН-ДВО РАН №№ 05-IIСМ-05-005, 06-II-СМ-05-004.
Источник: https://www.mimmun.ru/mimmun/article/download/188/190




